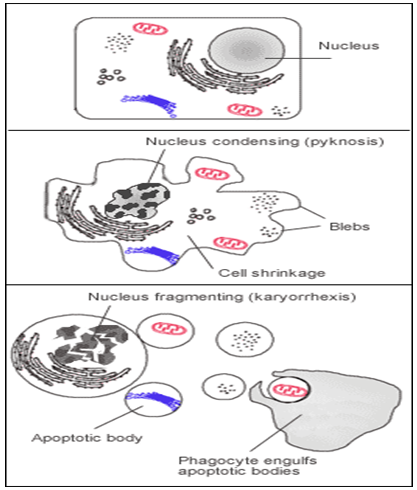
Apoptosis merupakan proses kematian sel yang terprogram yang terjadi pada organisme multiseluler [1]. Peristiwa biokimia yang menyebabkan perubahan karakteristik atau morfologi sel dan kematian. Hal tersebut melibatkan pengurangan jumlah sel, fragmentasi nukleus, kondensasi pada kromatin, fragmentasi pada DNA penyusun kromosom, dan lain-lain. Antara 50 dan 70 miliar sel yang mati setiap hari yang disebabkan oleh apoptosis dalam sel yang terdapat dalam manusia dewasa. Jumlah rata-rata sel pada anak-anak umur 8 dan 14 tahun, sekitar 20 sampai 30 miliar sel mati setiap harinya [2].
Pada hal yang sama pada necrosis, hal tersebut menghasilkan traumatic cell death yang dihasilkan dari acute cellular injury, apoptosis diregulasi sangat tinggi dan mengontrol proses kehidupan sel. Contohnya, pemisahan pada jari dan kaki dalam perkembangan embrio manusia yang terjadi karena setiap sel-sel di lokasi tersebut mengalami apoptosis. Tidak seperti nekrosis, apoptosis menghasilkan fragmen sel yang disebut apoptotic bodies seperti yang terdapat pada phagocytic cells [3].
Apoptosis tidak dapat dihentikan ketika sudah diregulasi, apoptosis diinisiasi melalui satu atau dua pathway. Pada intrinsic pathway, sel membunuh dirinya sendiri karena terdapat sense cell stress, selain itu dalam extrinsic pathway sel melakukan seperti itu karena sinyal dari sel lain. Kedua pathway menginduksi kematian sel yang diaktivasi oleh kaspase, protease, dan enzim degradasi protein. Dua pathway tersebut diaktivasi initiator caspases, kemudian akan menyebabkan aktivasi dari executioner caspases, hal tersebut akan mengaktivasi proses kematian sel. Penelitian pada apoptosis telah dilakukan sejak awal 1990, ketika sel tidak mengalami apoptosis hal tersebut akan menghasilkan proliferasi sel yang tidak terkendali seperti kanker. Suatu faktor seperti Fas receptors dan caspase promote apoptosis, dihambat oleh Bcl-2 family sehingga apoptosis tidak terjadi.
Umumnya aktivasi apoptosis terjadi melalui dua pathway yaitu intrinsic pathway (pathway mitokondria) dan extrinsic pathway [4]. Extrinsic pathway diaktivasi oleh sinyal intraseluler ketika sel mengalami stress dan tergantung pada pelepasan protein dari intermembran pada mitokondria [5]. Extrinsic pathway teraktivasi oleh ligan ekstraseluler yang berikatan pada cell-surface death receptors, hal tersebut akan menyebabkan terjadinya persinyalan kompleks pada death-inducing signalling complex (DISC) [6]. Sel menginisiasi persinyalan intracellular apoptotic pada respon dalam stress, hal tersebut memungkinkan terjadinya kematian terprogram pada sel. Reseptor inti pengikatan yaitu glucorticoids, panas, radiasi, nutrient deprivation, infeksi virus, hopxia [19], dan meningkatkan konsentrasi kalsium dalam sel [7] dan [8], seperti kerusakan pada membran, dapat meningkatkan regulasi dari sinyal apoptosis dari sel yang telah rusak. Komponen enzim seperti poly ADP ribose polymerase dapat meregulasi apoptosis [9].
Sebelum proses kematian sel, sinyal apoptosis menyebabkan regulasi protein untuk menginisiasi apoptosis pathway Pada tahapan tersebut memungkinkan persinyalan untuk menyebabkan kematian sel. Beberapa protein terlibat, tetapi dua metode telah diidentifikasi yaitu melibatkan fungsi dari organel mitokondria [10], atau secara langsung transduksi melalui adaptor proteins pada mekanisme apoptosis. Extrinsic pathway pada inisiasi teridentifikasi dalam beberapa penelitian toksin yang menyebabkan peningkatan konsentrasi kalsium dalam sel karena aktivitas obat, hal tersebut dapat memicu apoptosis melalui calcium binding protease yaitu calpain.
Gambar 1. Mekanisme seluler terjadinya apoptosis (Google Image)
Mitokondria merupakan organel yang sering ditemui dalam kehidupan organisme multiseluler. Apoptotic proteins menghasilkan efek terhadap mitokondria dalam pathway yang berbeda. Mereka menyebabkan pembengkakan pada membran mitokondria melalui pori-pori membran, dan menyebabkan peningkatan permeabilitas membrane mitokondria shingga dapat menyebabkan efektor apoptosis keluar [11]. Protein mitokondria seperti second mitochondria-derived activator of caspases (SMACs) dikeluarkan ke dalam sitosol diikuti peningkatan permeabilitas membran mitokondria. SMAC berikatan pada proteins yang menghambat apoptosis atau IAPs sehingga mencegah terjadinya aktivasi protein pro-apoptosis, dalam kondisi normal IAP menghambat aktivitas grup protein seperti cysteine proteases yang disebut kaspase [12], yang melakukan proses degradasi pada sel.
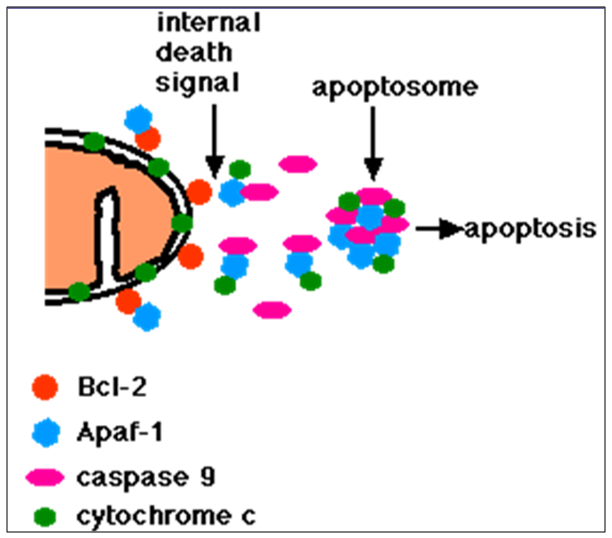
Sitokrom c juga dilepaskan dari mitokondria, mitochondrial apoptosis-induced chanel (MAC), pada membrane luar mitokondria [13]. Sekali sitokrom c dilepaskan, akan berikatan dengan apoptotic protease activating factor-1 (Apaf-1) dan ATP, kemudian berikatan pada pro-caspase-9 untuk menghasilkan kompleks protein yaitu disebut apoptosome. Apoptosome membelah, kemudian akan mengaktifkan effector caspase-3. Membrane attack complex (MAC) disusun oleh aktivasi komplemen, juga secara umumnya dilambangkan sebagai MAC, juga disebur sebagai Mitochondrial Outer Membrane Permeabilization Pore (MOMPP) yang diregulasi oleh berbagai macam protein, seperti dikode oleh Bcl-2 familly pada mamalia yang merupakan gen antiapoptosis. Protein Bcl-2 menyebabkan penghambatan apoptosis secara langsung pada MAC/MOMPP [14].
Gambar 2. Mekanisme intrinsic pathway picu apoptosis (Google Image)
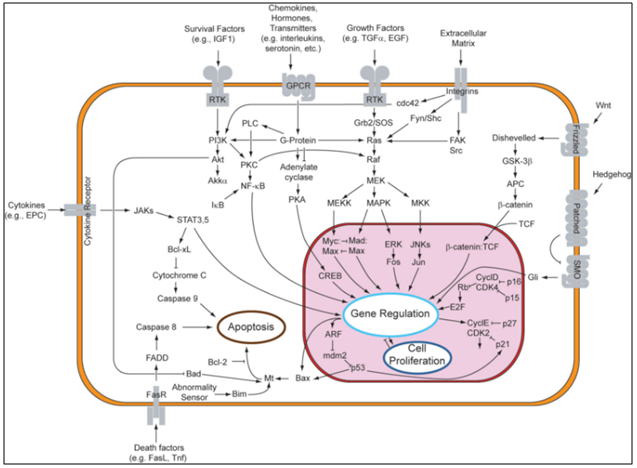
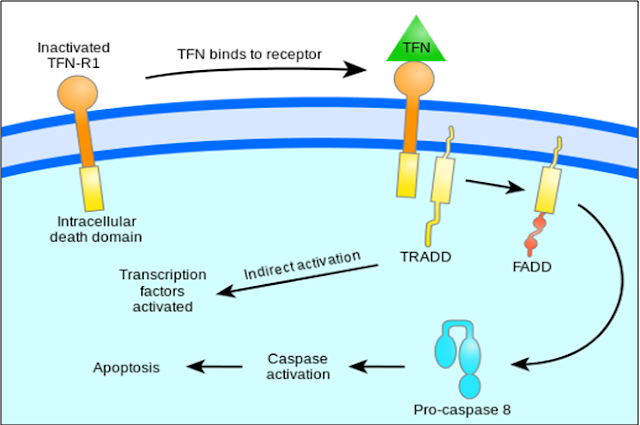
Terdapat dua teori yang menjelaskan inisiasi secara langsung mekanisme apoptosis dalam mamalia seperti TNF-induced (tumor necrosis factor) dan Fas-Fas-ligand-mediated model, keduanya melibatkan reseptor pada reseptor TNF (TNFR family [15]. TNF-α merupakan produksi sitokin oleh aktivasi makrofag dan tergolong mediator ekstrinsik sinyal apoptosis. Kebanyakan sel dalam tubuh manusia mempunyai dua reseptor TNF yaitu TNFR1 dan TNFR2. Pengikatan TNF-α pada TNFR1 menunjukkan inisiasi pathway melalui aktivasi caspases melalui membran intermediet protein TNF receptore-associated death domain (TRADD) dan Fas-associated death domain protein (FADD). clAP1/2 dapat menghambat persinyalan TNF-α oleh pengikatan pada TRAF2. FLIP menghambat aktivasi dari caspases-8 [16]. Pengikatan secara langsung pada reseptor tersebut dapat mengaktifkan aktivasi tidak secara langsung yaitu dari faktor transkripsi yang terlibat dalam sel survival dan respon inflamasi [17].
Gambar 3. Overview sinyal transduksi pada pathway apoptosis (Google Image)
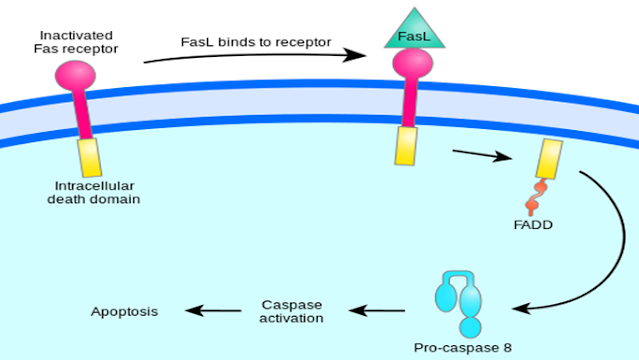
Reseptor Fas (sinyal apoptosis pertama) atau dapat juga disebut sebagai Apo-1 atau CD95 merupakan protein transmembran yang tergolong TNF-family yang berfungsi untuk pengikatan Fas ligand (FasL). Interaksi antara Fas dan FasL menghasilkan formasi yaitu death-inducing signalling complex (DISC), yang mengandung FADD, caspases-8 dan caspases-10. Pada suatu tipe sel, proses dari caspases-8 mengaktifkan secara langsung member lain dari keluarga kaspase, dan meningkatkan regulasi apoptosis pada sel [15].
Gambar 4. Persinyalan TNF untuk regulasiapoptosis (Google Image)
Mengacu pada TNFR1 dan aktivasi Fas dalam sel mamalia maka akan terjadi keseimbangan antara proapoptosis (BAX, BID, BAK, atau BAD) dan antiapoptosis (Bcl-XL dan Bcl-2) member dari Bcl-2 family. Keseimbangan merupakan proporsi dari proapoptotic homodimer yang disusun dalam membran luar mitokondria. Proapoptotic homodimer dibutuhkan untuk memnghasilkan peningkatan permeabilitas membran serta pelepasan caspase activators seperti sitokrom c dan SMAC [18]. Caspases berperan dalam sinyal transduksi ER apoptotic signals. Caspases adalah protein yang highly conserved pada cysteine-dependent aspartate-specific proteases. Disana terdapat dua jenis caspases yaitu caspases initiator (caspases 2, 8, 9, 10, 11, 12) dan efektor caspases (caspases 3, 6, dan 7). Aktivasi caspase initiator dibutuhkan untuk pengikatan pada specific oligomeric protein activator. Caspases efektor kemudian diaktivasi oleh inisiator aktif melalui proteolytic cleavage. Caspase efektor yang aktif secara proteolitik menurunkan beberapa protein intraseluler untuk mengaktivasi apoptosis [19].
Gambar 5. Persinyalan Fas untuk regulasiapoptosis (Google Image)
Penghambatan proses apoptosis pasti menghasilkan kanker, penyakit autoimun, inflamasi, dan infeksi virus. Hal tersebut secara alami dipercaya berasosiasi dengan peningkatan proliferasi sel, tetapi sekarang juga diketahui menyebabkan penurunan pada kematian sel. Secara umumnya dapat menyebabkan kanker, penyakit tersebut disebabkan karena proliferasi yang berlebihan, hal tersebut sering menyebabkan member family IAP mengalami overekspresi. Hasil menunjukkan sel kanker bersifat abnormal untuk merespon induksi apoptosis pada siklus regulasi gen (seperti p53, rasa tau c-myc) yang mengalami mutasi atau tidak aktif dalam sel yang terjangkit kanker, dan gen lebih lanjut (seperti bcl-2). Suatu faktor vital apoptosis saat respirasi mitokondria yaitu sitokrom c [20].
Infeksi human immunodeficiency virus (HIV) dalam AIDS dapat menurunkan jumlah sel CD4+ T helper lymphocytes. Terdapat mekanisme sel T CD4+ tidak meregulasi apoptosis karena pada saat infeksi, berikut merupakan berbagai cara HIV menghentikan apoptosis pada sel hospes. Enzim HIV dapat menonaktifkan anti-apoptosis Bcl-2. Hal tersebut secara tidak langsung menghasilkan kematian sel. Namun dalam kasus infeksi HIV, enzim tersebut dapat mengaktivasi procaspases-8 tetapi protein tersebut tidak dapat secara langsung menginisiasi apoptosis melalui mitokondria. HIV dapat menurunkan jumlah marker CD4 glycoproteins yang ditampilkan pada sel membran. HIV menurunkan produksi molekul pada sel yang terlibat dalam proses apoptosis dan memberikan partikel virus untuk melakukan replikasi.
Tanya-tanya? DM ke IG @violthebiologist
Penulis
Viol Dhea Kharisma, S.Si., M.Si
(Content Creator & Peneliti Biologi)
Follow Instagram @violthebiologist
Follow Facebook Viol The Biologist
Follow TikTok @violthebiologist
Bahan Bacaan:
[1]. Green., D. 2011. Means to an End: Apoptosis and other Cell Death Mechanisms. USA: Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-888-1.
[2]. Karam., J.A. 2009. Apoptosis in Carcinogenesis and Chemotherapy. Netherlands: Springer. ISBN 978-1-4020-9597-9.
[3]. Alberts, B., Johnson, A.L.J. Raff, M.R. & Keith, W.P. 2008. Chapter 18 Apoptosis: Programmed Cell Death Eliminates Unwanted Cells. Mol. Biol. Cell. p. 1115. ISBN 978-0-8153-4105-5.
[4]. Alberts, p. 1023.
[5]. Böhm, I., & Schild, H. 2003. Apoptosis: the complex scenario for a silent cell death. Mol. Imaging. Biol. 5(1): 2–14. doi:10.1016/S1536-1632(03)00024-6. PMID 14499155
[6]. Alberts, p. 1024.
[7]. Mattson, M.P., & Chan, S.L. 2003. Calcium orchestrates apoptosis. J. Nat. Cell. Biol. 5(12): 1041–1043. doi:10.1038/ncb1203-1041. PMID 14647298
[8]. Uguz, A.C., Naziroglu, M. Espino, J. Bejarano, I. González, D. Rodríguez, A.B. & Pariente J.A. 2009. Selenium Modulates Oxidative Stress-Induced Cell Apoptosis in Human Myeloid HL-60 Cells Through Regulationof Calcium Release and Caspase-3 and −9 Activities. J Membrane. Biol. 232:15–23. doi:10.1007/s00232-009-9212-2.
[9]. Chiarugi, A., & Moskowitz, M.A. 2002. PARP-1—a perpetrator of apoptotic cell death. J. Sci. 297(5579): 259–63. doi:10.1126/science.1074592. PMID 12114611
[10]. Bejarano, I., Espino, J. González-Flores, D. Casado, J.G. Redondo, P.C. Rosado, J.A. Barriga, C. Pariente, J.A. & Rodríguez, A.B. 2009. Role of Calcium Signals on Hydrogen Peroxide-Induced Apoptosis in Human Myeloid HL-60 Cells. J. Biomed. Sci. 5 (3): 246–256. PMC 3614781 Freely accessible. PMID 23675144
[11]. Cotran., R.S. & Kumar, C. 1998. Robbins Pathologic Basis of Disease. Philadelphia: W.B Saunders Company. ISBN 0-7216-7335-X.
[12]. Fesik, S.W., & Shi, Y. 2001. Controlling the caspases. J. Sci. 294(5546):1477–8. doi:10.1126/science.1062236. PMID 11711663
[13]. Laurent, M., Dejean, S.M.C. & Kathleen, W.K. 2006. Is MAC the knife that cuts cytochrome c from mitochondria during apoptosis. J. Cell. Death. and Differentiation. 13 (8):1387–5. doi:10.1038/sj.cdd.4401949. PMID 16676005
[14]. Dejean, L.M., Martinez-Caballero, & Kinnally, K.W. 2006. Regulation of the mitochondrial apoptosis-induced channel, MAC, by BCL-2 family proteins. J. Biochim. Biophys. 1762 (2): 191–201. doi:10.1016/j.bbadis.2005.07.002. PMID 16055309
[15]. Wajant, H., 2002. The Fas signaling pathway: more than a paradigm. J. Sci. 296(5573): 1635–6. doi:10.1126/science.1071553. PMID 12040174
[16]. Chen, G., & Goeddel, D.V. 2002. TNF-R1 signaling: a beautiful pathway. J. Sci. 296 (5573): 1634–5. doi:10.1126/science.1071924. PMID 12040173.
[17]. Goeddel, D.V. 2007. Connection Map for Tumor Necrosis Factor Pathway. J. Sci. tw132. doi:10.1126/stke.3822007tw132
[18]. Murphy, K.M., Ranganathan, V. Farnsworth, M.L. Kavallaris, M. & Lock R.B. 2000. "Bcl-2 inhibits Bax translocation from cytosol to mitochondria during drug-induced apoptosis of human tumor cells. J. Cell. Death. Differ. 7 (1): 102–11. doi:10.1038/sj.cdd.4400597.
[19]. Susin SA, Lorenzo HK, Zamzami N (February 1999). Molecular characterization of mitochondrial apoptosis-inducing factor. J. Nat. 397 (6718): 441–6. doi:10.1038/17135. PMID 9989411
[20]. Kaczanowski, S. Apoptosis: its origin, history, maintenance and the medical implications for cancer and aging. J. Phys. Biol. 031001 http://iopscience.iop.org/article/10.1088/1478-3975/13/3/031001



.jpg)